Por Alberto Jiménez Schuhmacher
Soy científico, investigo contra el cáncer y muy a menudo me preguntan cuándo vamos a acabar con él. Siempre contesto que el cáncer no es una enfermedad, son más de 200. Empezamos a plantar cara a muchos tumores y a recoger los frutos del esfuerzo de muchos años de investigación.
Alberto Jiménez Schuhmacher
A todos nos resulta fácil entender que el sida, el sarampión, un herpes, el ébola y la gripe son enfermedades distintas, pese a ser todas ellas enfermedades víricas. Del mismo modo debemos entender que no es lo mismo un cáncer de mama que uno de páncreas. Comúnmente para denominar un tumor nombramos el órgano donde ha aparecido precedido de la palabra cáncer. Decimos cáncer de mama, páncreas, pulmón… pero en un mismo órgano pueden formarse tumores de muy diversos tipos. Algunos se pueden extirpar, unos se tratan mejor que otros. Para otros debemos seguir investigando. Al cáncer debemos ponerle nombre y apellidos.
Hasta hace relativamente poco no sabíamos prácticamente nada de cómo se origina un tumor. En 1971 Nixon declaró la Guerra al Cáncer con el objetivo de encontrar una cura al final de la década. Intentaba emular a Kennedy y su gran salto para la humanidad al final de la década anterior. Fueron dos lustros donde aprendimos mucho y que nos enseñaron que el enemigo en esta guerra era más complejo de lo anticipado.
Mariano Barbacid mostraba el descubrimiento del primer oncogén en humanos y su mecanismo de activación dejando al descubierto cuál era la “esencia” del cáncer. Esto ocurría mientras España se preparaba para celebrar su Mundial de Fútbol en el año 1982.
Al cáncer hay que ponerle nombre y apellidos, pero todos los tumores presentan unos rasgos comunes. Las células tumorales se vuelven inmortales, egoístas y viajeras. Estimulan su propio crecimiento, resisten las señales inhibidoras que de otro modo lo pararían, evaden la apoptosis (muerte celular programada), se hacen inmortales. Alteran su metabolismo y se vuelven egoístas. Adquieren la capacidad de invadir el tejido sano adyacente, de moverse y viajar para formar metástasis.
Nuestra mirada al cáncer está cambiando. Ya no vemos los tumores como una masa de células que ha alcanzado el sueño de la inmortalidad, aunque sea con fines perversos. Lo comenzamos a mirar como un crimen celular organizado.
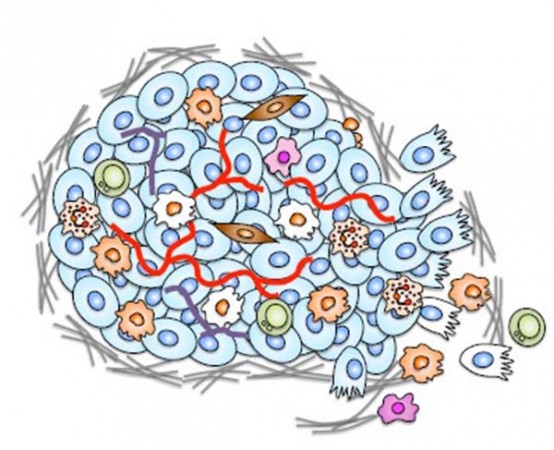
Visualiza esa película en la que van a hacer el robo del siglo. Para dar el golpe a un gran banco hace falta una banda bien organizada. Uno es el cerebro que coordina todo, pero necesita ayuda. En su equipo alguien esperará con un coche en la puerta, otro deberá amordazar al guardia y con lo complejas que son las cámaras acorazadas de hoy en día… requerirá un soldador, un experto en explosivos y un informático. Al menos. El cáncer es un crimen celular organizado. Como en todo gran golpe hay un cerebro, el jefe son las células tumorales, pero no están solas. Desde que comenzamos la guerra contra el cáncer gracias a la investigación hemos aprendido que en un tumor existen células normales que son engañadas por las células tumorales y explotadas en su propio beneficio. A todo este equipo que apoya y rodea al tumor se le conoce como el microentorno tumoral.
Así, en el tumor encontramos unas células que le dan soporte (fibroblastos), también vasos sanguíneos que aportan oxígeno y nutrientes. Además las células del sistema inmune, los policías del cuerpo, están compinchados y en lugar de atacar al tumor le protegen y ayudan a expandirse. Muchos otros tipos participan en el crimen. Existe un diálogo molecular entre ellas, se comunican e intercambian factores de crecimiento.
- Figura 1. Esquema de los componentes del microentorno de un tumor
Muchas investigaciones en los laboratorios de todo el mundo están dirigidas actualmente a atrapar a los compinches. A infiltrarse en la banda para desarmarla. Es esto consiste la inmunoterapia que se anuncia como la nueva gran promesa pero esta vez viene con resultados y podría revolucionar la forma de tratar los cánceres. Re-educar y estimular al sistema inmune para que elimine al tumor.
Hace algo más de una década se mostró el camino hacia el diseño de racional de fármacos contra el cáncer, nació Gleevec. Este fármaco cura, o al menos controla la leucemia mieloide crónica. Padecer este tipo de leucemia era una sentencia de muerte hasta el momento en el que se aprobó este fármaco. Ahora basta con tomar una pastilla. Gleevec ilustra como el conocimiento humano sobre la enfermedad lleva al éxito deseado.
Las leucemias son tumores de células de la sangre. En los años 50 se podía ver contando las células de la sangre que había más glóbulos blancos, más células mieloides en estos pacientes. Un década más tarde, mientras sonaban los éxitos de los Beatles se pudo hacer un cariotipo, una foto de los cromosomas. Había uno raro, el 22 era más corto. Se podía distinguir a pacientes con esta leucemia de otras similares y servía para predecir un poco la mala respuesta a la quimioterapia de entonces. Años más tarde, ya en los 70, gracias a las mejoras introducidas en esta técnica pudo determinarse que lo que ocurría era una traslocación, un intercambio de fragmentos de ADN entre el cromosoma 9 y el 22. A la forma aberrante se le llamó cromosoma Filadelfia.
Poco tiempo después irrumpió con fuerza la biología molecular y al tiempo empezábamos a entender qué eran los oncogenes. Para aquel entonces ya se podían secuenciar pequeños fragmentos de ADN y se pudo determinar que justo en el punto de fusión de estos dos cromosomas se habían truncado y pegado los genes que allí estaban. Uno era BCR, del cromosoma 22 mientras que en el cromosoma 9 se había partido el gen ABL. La fusión de ambos fragmentos de genes forma un gen híbrido BCR-ABL que codifica una proteína híbrida. Es una proteína truncada hiperactiva. Es una enzima del tipo quinasa, enzimas que ponen fosfatos en otras proteínas para modificarlas y así ejecuten su función. Detalles bioquímicos pero que son importantes para los científicos extrajesen información en los años siguientes y les permitiese desarrollar un compuesto químico que se clavaba en el corazón de la proteína híbrida dejándola inactiva.
Este fármaco es Gleevec, y al pegarse a esta proteína híbrida oncogénica conduce a la eliminación inmediata de estos glóbulos blancos malignos ya dependen totalmente de esta proteína híbrida para sobrevivir. A finales de los 90 se llevaron a cabo los ensayos clínicos y fueron tan contundentes que hubo que pararlos para no privar a ningún enfermo de un medicamento tan efectivo.
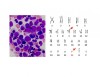
- Figura 2. Imagen de una muestra de Leucemia Mielode Crónica vista al microscopio (izda.) y su cariotipo con el cromosoma Filadelfia (dcha. Crs.22).
Las células tumorales desarrollan resistencias a los medicamentos y esto también paso con Gleevec. Pero se tenía un gran conocimiento de la proteína híbrida y del fármaco lo que permitió determinar su mecanismo de resistencia y diseñar nuevos “super-Gleevecs” alternativos frente a las nuevas formas resistentes. ¡Investigar funciona!
Pero ¿por qué no hay más Gleevecs uno para combatir cada tipo tumoral? La mayoría de tumores no son como esta leucemia que depende exclusivamente de un oncogén y precisan del acúmulo de numerosas mutaciones. Esto que es malo para encontrar tratamientos es bueno porque hace más difícil que se formen tumores.
Las células tumorales adquieren muchas mutaciones antes de ser totalmente oncogénicas y ya no basta con bloquear una diana. Otra complicación es que las células tumorales van cambiando su comportamiento. El tumor al atraer vasos sanguíneos atrae las vías de salida y escape de células tumorales. La mayoría muere pero algunas acumulan las alteraciones necesarias para poder crecer en otros órganos formando así metástasis. El tumor inicial, el tumor primario es fácil de eliminar, pero las metástasis son más complicadas de tratar. Pero estamos avanzando mucho en este conocimiento también.
Se han mejorado las cirugías y cada vez son menos invasivas y más precisas. Se han implementado los métodos de diagnóstico. Se empiezan a ensayar nuevas terapias. Hemos avanzado mucho y se puede decir que más de la mitad de los tumores se curan.
Tenemos mejores modelos animales que reproducen mejor los tumores que encontramos en pacientes. Nos están ayudando a aprender nuevas cosas sobre el cáncer y nos permiten ensayar terapias. En estos años la investigación no se ha parado y ha permitido que se desarrollen numerosas tecnologías. Tenemos preparado el desembarco para esta guerra contra el cáncer. Se han desarrollado la bioinformática y un montón de tecnologías que hacen que vivamos un momento apasionante en los laboratorios. Procesos que antes precisaban años se hacen en horas.
Uno de los mayores avances ha sido la secuenciación del genoma humano. El primero se presentó en el año 2001. Costó 3.000.000.000 de dólares y se tardó en completarlo más de 10 años. Hoy se puede secuenciar una muestra por menos de 2.000 dólares en 48 horas.
La secuenciación de los genomas del cáncer nos está abriendo la puerta para comprender lo que pasa en cada tumor de cada paciente y tratarlo con la terapia más adecuada. Empezamos a desenmarañar y a poner una mirada humana al naufragio genómico de los tumores. En unos años no será necesario tomar una biopsia de un tumor para poder hacerlo y valdrá con analizar el genoma de las células tumorales que han escapado al torrente sanguíneo. A esto le llamamos biopsia líquida.
En los últimos años se han producido avances muy significativos. Entendemos mejor la biología del tumor, de los tumores. Los resultados de estas investigaciones tardarán un tiempo en llegar a la farmacia. Desde que descubre algo en el laboratorio hasta que llega a la clínica pasan más de 10 años. Eso cuando se da la fortuna de que el descubrimiento se traduce en algo que pueda llegar al paciente. Los medicamentos que disponemos ahora son el resultado de investigaciones del siglo pasado. La investigación de hoy es la medicina de mañana. Estamos en la década D de la guerra contra el cáncer.